Валенттік байланыстар әдісі
Валенттік байланыстар әдісі — көрнекі және әртүрлі молекулалар мен иондардың құрылымын, қасиетін оның ішіндегі кеңістіктегі конфигурациясын, үйектілігін, байланыстың энергиясы мен ұзындығын және т.б болжауға мүмкіндік береді. Бұған қарамастан бұл әдіс заттың магниттік қасиетін, жұптаспаған электрондары бар молекулалардың санын және бірқатар басқа құбылыстарды түсіндіре алмайды.
Ашылуы
өңдеу1928 жылы неміс ғалымдары В.Гейтлер және Ф.Лондон валенттік байланыстар әдісін ұсынып, онымен сутек молекуласының кванттық механикалық есептеулерін жүргізді. Кейінірек бұл әдісті Л.Полинг дамытып 1954 жылы Химия саласындағы Нобель сыйлығына еге болды.
Ережелері
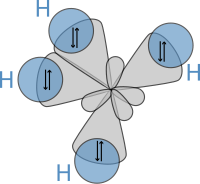
өңдеу- Байланыстарды түзуге тек сыртқы электрондық қабатындағы электрондар қатысады.
- Химиялық байланыстарға түсуші атомдар өзара электрондарымен алмасады да бұл электрондар байланыстырушы жұптарды түзеді.
- Химиялық байланыс Паули қағидасымен сәйкестікте, тект антипараллельді спиндері бар элекрондармен әрекеттескенде ғана түзіледі, мұндайда электронық орбитальдардың қайтпаа жабылуы жүреді де атом ядроларыының арасындағы байланыспен шарттасатын, атом арасында электрондық тығыздылық жоғарылаған аймақ пайда болады.
- Химиялық байланыстың сипаттамалары атомдық орбитальдардың қайта жабылу ытипімен анықталады.
- Молекулалар түзілген кезде электрондық құрылым және әрбір атомның химиялық өзінділігі негізінде сақталынады.
Қасиеттері
өңдеуВаленттік байланыс теориясына сәйкес коваленттік байланыстар әрекеттесуші атомдардың АО максималды қайта жабу жағына бағытталған. Химиялық байланыстарды түзумен қатар атомның қосып алу және басқа атомдардың белгілі санының орнын басу қабілеттілігн валенттілік деп атайды. Валенттік байланыстар әдісінің алмасымдық механизміне орай ортақ электрондық жұп түзуге әрбір атом жұптаспаған бір электроннан береді. Валенттік байланыстар әдісінде алмасымдық механизміндегі валенттіліктің сандық өлшемі ретінде атомның негізгі немесе қоздырылған күйде болатын атомдағы жұптаспаған электрондар санын есептейді. Бұл сыртқы электрондық қабаттың жұптаспаған электрондары s және p элементтердің сыртқы және оның ішкері жағындағы қабатта, сол сияқты f элементтердің сыртқы үш қабаттарында болады.
Атомның қоздырылған күйге ауысуы элемент валенттілігінің артуына жағдай және ауыспалы валенттіліктің бар болуына мүмкіндік жасайды. Мысалы, оттек пен фтор атомдарындағы электрондық жұптар бөліне алмайды, өйткені екінші қабатта бос орбитальдар жоқ.[1]
Дереккөздер
өңдеу- ↑ Жалпы химия, I том, Алматы-2003 жыл, С.Ж.Пірәлиев, Б.М.Бутин, Г.М.Байназарова, С.Ж.Жайлау